Нов свят - Да живеем и да спасяваме живот
Очакваше се Регламентът за медицинските изделия (MDR) да започне да се прилага в Европейския съюз от 26 май 2020 г.
Все пак след години обсъждане новата рамка ще бъде скоро реалност. Производителите, държавните агенции, регулаторните органи и потребителите трябва да я спазват. Какво означава това за нас? Повишава ли MDR безопасността на пациентите? Или води до ограничаване на възможностите за иновации в сектора? И: Какви са следващите ни стъпки? Ексклузивна анкета на B. Braun на всички нива на системата на здравеопазването: Една реформа. Седем аспекта. Седем гледни точки.
Аспект 1: Идеята
Андреас Шваб е член на Европейския парламент от 2004 г. През почти цялото това време политикът от ХДС работи по въпросите на MDR. „Натискът върху политиците беше огромен, казва Шваб, а отразяването в медиите беше доста субективно. Това много затрудни работата ни.“ MDR беше приет през май 2017 г. Очаква се да приключи тригодишният преходен период за първите класове изделия. Андреас Шваб обаче е наясно, че ще занимава с темата още дълго време.
„През 2010 г. дефектни гръдни импланти от производителя Poly Implant Prothèse станаха повод за масово възмущение във Франция. Начинът, по който тази фирма правеше бизнес, не съответстваше на разпоредбите, дори и в контекста на онзи момент. Все пак така нареченият PiP скандал показа ясно, че липсват ефективни начини за контрол. Сега за пръв път MDR урежда уеднаквено прилагане на разпоредби в Европа. Предвидени са и внезапни инспекции. Това повишава безопасността на пациентите. Поех работата по декларацията на становище за MDR от френски колега в Комисията по вътрешен пазар и защита на потребителите в Европейския парламент - проведох множество разговори с фирми и учени от моя избирателен район и поканих Комисията в югозападна Германия. Затова много добре разбирам защо някои производители се оплакват, че трябва да доказват ефективността и безопасността на съществуващи изделия. Макар проблемите да идват само от няколко черни овце. Трябва да гарантираме, че всички продукти отговарят на най-съвременните стандарти, за да се осигури възможно най-високата безопасност за пациентите. Преди известно време изразих тревога, че Европейският парламент е твърде амбициозен що се касае до сроковете за изпълнение. Нещата обаче се подобриха. По отношение на изпълнението на MDR имаме нужда от съчетание на ред и скорост.“
Аспект 2: Стратегията
В края на 2019 г. Европейската комисия отложи сроковете в рамките на които така наречените изделия от Клас 1R, като например хирургически инструменти за многократна употреба, трябва да бъдат сертифицирани по новия регламент. Помага ли това на производителите? Подразделението „Ескулап“ на B. Braun произвежда медицински изделия в Тутлинген от 1867 г. Членът на съвета на B. Braun д-р Йоахим Шулц обяснява защо няма връщане назад.
„MDR предлага ясни предимства за пациентите: аз например смятам, че е вярно, че производителите вече не могат просто да разчитат на принципа на еквивалентност при одобряване на изделия от клас III, като например импланти, а трябва да провеждат нови клинични изпитвания. Ако обаче трябва да доказваме, че дадена конструкция на хирургични ножици, някои от които произвеждаме и доставяме вече над 100 години, може да бъде стерилизирана с пара, това води до излишно блокиране на ресурси и до намаляване на възможностите ни за иновации. MDR създаде нов свят. 50 до 60 процента от служителите ни в отделите по развойни дейности и нормативни въпроси в момента са заети с водене на документация за съществуващи изделия. Бидейки голямо дружество, B. Braun поне има възможността да извършва голяма част от вече задължителните изпитвания в собствени бази. Не смятаме да почиваме на старите си лаври, а как да се развиваме в бъдеще. Технологиите се променят бързо: нововъведения, като например ефективни повърхности, които предотвратяват възпаления, или роботизацията на операционни, обещават огромен потенциал. Честно казано за нас е по-добре да изобретяваме революционни изделия, отколкото да се взираме в папки.“
Д-р Йоахим Шулц, член на съвета на B. Braun Melsungen AG
MDR променя не само работата на производителите на медицински изделия: всички нотифицирани органи също ще загубят предназначението си по старата директива на ЕС за медицинските изделия. Докато през 2012 г. все още имаше 83 нотифицирани органа в цяла Европа, в момента са едва десет. А този брой не може да бъде увеличен изведнъж, защото процесът по прилагане отнема година и половина, както обяснява д-р Базил Акра, Вицепрезидент по глобално стратегическо бизнес развитие в TÜV SÜD в Мюнхен.
„От 2015 г. насам ние в TÜV Süd повишаваме капацитета си с по 20 процента годишно. Независимо от това нямаме възможност веднага да обработим всички заявки от производителите за сертифициране по MDR. Въпреки това в момента не виждам спешна ситуация по отношение на наличностите от медицински изделия, тъй като повечето производители към момента са съсредоточили усилията си в удължаване на сертифицирането на изделията си до 2024 г. Ето защо реалната работа по MDR предстои в бъдеще. По принцип смятам, че повишен мониторинг и хармонизация на правната обстановка, предвидена в MDR, са напълно логични. Дългият 175 страници регламент обаче съдържа доста неясноти и оставя място за тълкуване. Така например в него се казва, че нотифицираните органи трябва да осигурят „адекватни системи за надзор“. Но какво реално означава „адекватни“? До момента са публикувани 32 документа с насоки, чрез които Европейската комисия възнамерява да изясни позицията си. До месец май 2020 г. предстои да бъдат публикувани още 30. И, разбира се, трябва да признаем че в Европа не може да бъде постигната 100% хармонизация. Просто езиците, културите и правните традиции на държавите членки са различни. Ако, например, в регламента се посочва, че изследователите от нотифицираните органи трябва задължително да притежават „клиничен експертен опит“, то в Германия под това разбираме лекар с квалификация на специалист. В други държави е достатъчно изследователите да притежават бакалавърска степен по сестрински грижи или, да си го кажем честно, просто да са работили в клиника. Може и да не ви харесва. Но това е част от разнообразието в днешна обединена Европа“
Аспект 4: Вътрешният процес
Само подразделението по болнични грижи на B. Braun има 40 обекта. Медицински изделия се произвеждат в 18 от тях. Юрегн Хайл, старши вицепрезидент по управление на качеството и околната среда, обяснява как MDR променя сложни производствени процеси.
„Започвайки от празен лист хартия преработихме изцяло процесите по качеството и техническата документация от отделите по клинично управление, развой, производство и управление на жизнения цикъл. Това беше гигантски проект, в който само в нашето подразделение по болнични грижи бяха ангажирани над 100 експерта от всички звена в продължение на няколко години: управление на качеството, нормативни въпроси, развойна дейност, производство, научно-медицински въпроси, правни въпроси, ИТ, маркетинг и продажби. MDR въвежда толкова много нови изисквания, че се наложи да разгледаме подробно всичките си външни и вътрешни процеси и при необходимост да ги реорганизираме. Успяхме да изпълним някои задачи доста бързо: например сертифициране на управлението на качеството по най-новия стандарт (ISO 13485:2016) в края на 2018 г. Задачата, с която все още се занимаваме, е че всеки продукт, освен с етикета за медицинско изделие, трябва да е снабден и с код за уникална идентификация на изделието, който се извежда в европейска база данни (EUDAMED). Тази база данни обаче няма да е налична в обозримо бъдеще. За над 140 продуктови семейства, като например интравенозни комплекти или интравенозни катетри, се наложи да създадем техническа документация и доказателство за валидиране и да ги предоставим на разположение в база данни съгласно стандартизирана процедура. Става въпрос за до 140 документа за едно устройство. Но тъй като работим активно по тази тема още от края на 2016 г. – така например планирахме ресурси в нашия Нотифициран орган преди една година – завършихме успешно одита по MDR през септември миналата година. Движим се добре и мога да успокоя клиентите ни, които се свързаха с нас с въпроси за наличности и сертифициране. Все пак се наложи да извадим някои изделия и комплекти от нашето портфолио. За продукти от външни производители, например, съгласно новия регламент сме длъжни да докажем, че имаме достъп до тяхната техническа документация, което често пъти изобщо не е разрешено.“
Аспект 5: Пазарът
Асоциацията на закупчици Prospitalia представлява над 1 000 медицински институции с годишен обем на покупки от 1,7 милиарда евро. За да се ограничи несигурността в клиниките, аптеките и домовете за възрастни хора, през 2019 г. компанията проведе мащабно проучване на всички свои доставчици на медицински изделия. Един от изводите беше, че почти две трети от производителите вече работят с нотифициран орган, акредитиран по MDR. Катя Винкелс цур Щрасен, Бизнес консултант в Prospitalia, ни разказа как да оценим ситуацията.
„Светът няма да свърши на 26 май 2020 г. Комисията на ЕС взе мерки в това отношение, като удължи преходните периоди за повечето медицински изделия. Но дори и това да не се беше случило, установихме, че има малко повод за тревога. Само преди година обаче много от контактите ни от болниците и доставчиците не бяха добре информирани за MDR. Много например не знаеха дали ако продуктите вече се съхраняват в клиниките, все още могат да се използват след изтичане на CE. Дали има смисъл да се запасят с продукти за еднократна употреба, като например катетри. Отговорът: Да, защото непосредствено след като даден продукт достигне до болницата и така стане на разположение на потребителя, той се смята за „въведен в експлоатация“. По-специален е случаят, когато най-вече големи изделия се сглобяват на място: въвеждането в експлоатация се извършва едва след завършване на монтажа. Като асоциация на закупчици, ние се намираме между производителите и потребителите и така изпълняваме функция на пропускателен пункт. За да постигнем по-голяма прозрачност на пазара, през лятото на 2019 г. проведохме проучване и го изпратихме до 180 производителя, които ни снабдяват: 64 процента - измерено по обема на поръчките на свързаните институции - работеха с нотифицирани органи, които вече бяха акредитирани по MDR. И най-малко осем процента планират да изтеглят изделия от пазара. Предполагаме също така, че ще настъпи консолидиране на пазара. Това все пак би било съвсем логично. Така например някои лекари по навик работят с остарели изделия, въпреки че има по-съвременни алтернативи, които пациентите понасят по-добре: тежките мрежи за хернии с малки отвори например стават причина за реакция към външно тяло по-често, отколкото съвременните изделия. За случаите на изделия, предназначени за много малки ниши, като например в педиатрията, има възможност законодателството да гарантира наличност чрез освобождаване от изискванията на национално ниво. Интересен ще бъде въпросът за динамиката на цените. Според проучването ни много малко производители планират да увеличат цените. MDR обаче ще доведе до удвояване на разходите за сертифициране.“
Аспект 6: Средните предприятия
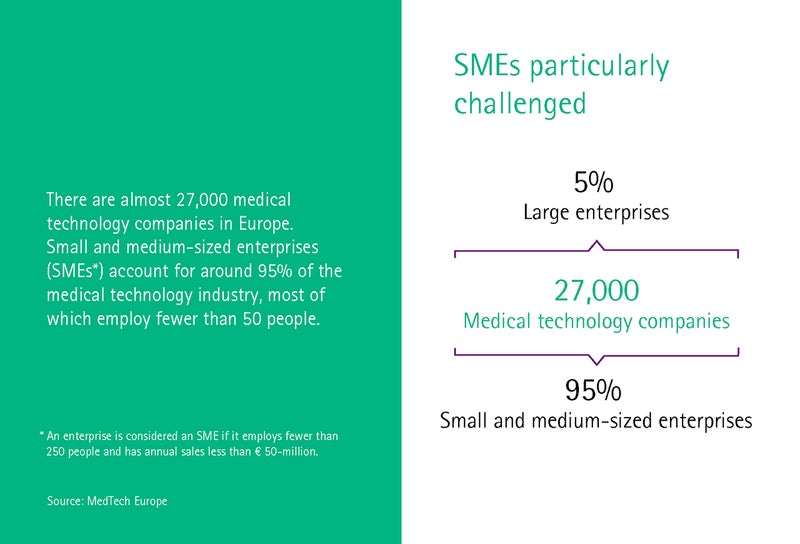
Секторът на медицинските технологии в Германия се характеризира със средни по големина предприятия. 93 процента от фирмите имат персонал под 250 души, а 30 процента са с под десет души персонал. Медицинският технологичен клъстер Medical Mountains от Тутлинген работи с много от тези малки предприятия и стартъпи и им помага да се подготвят за MDR, както ни разказва Управляващият директор Ивоне Глинке.
„Ако се разходите днес по улиците на Тутлинген като специалист по нормативни въпроси, няма начин да не получите предложения за работа. Малките производители са особено засегнати от проблема с привличането на необходимите им квалифицирани работници. През 2019 г. в Medical Mountains организирахме над 94 семинара с над 1000 участници. Акцентът определено беше върху теми като управление на качеството и сертифцирания. MDR води до консолидиране на пазара. Най-вече малките фирми все по-често отговарят с „не“ на въпроса дали усилието си струва – обединяват усилия, продават или променят бизнес модела си и работят като удължена работна маса за основните си клиенти. Участвахме в работата по MDR над десетилетие, разговаряли сме с политици, писали сме предложения – и продължаваме да се борим за по-практично прилагане. Защо например трябва да има хартиени инструкции за употреба на всички езици в ЕС за всеки скалпел за еднократна употреба? Мога да предположа, че някои фирми пускат иновативните си изделия първо в САЩ или Китай, за да заобиколят MDR. Във всеки случай обаче MDR има едно предимство: сътрудничество между фирмите в региона се подобри съществено. Има по-малко конкуренция и повече сътрудничество. Това може да доведе до нещо ново.“
Аспект 7: Човешкият фактор
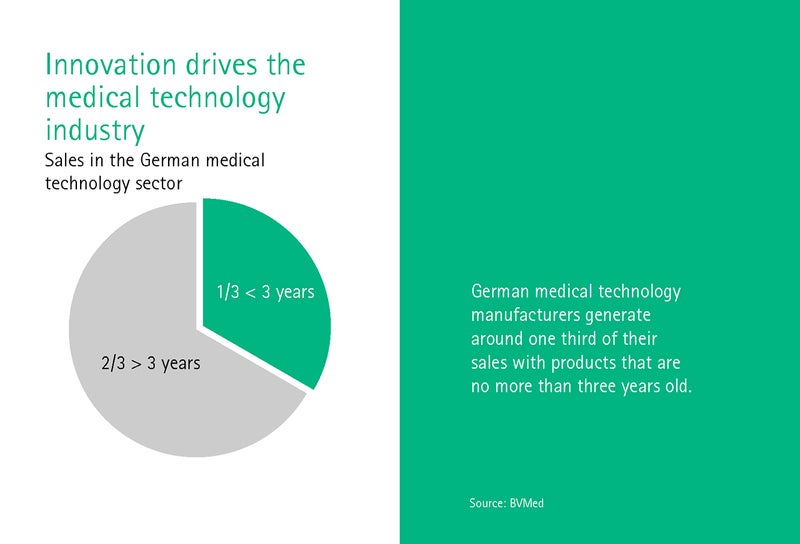
Д-р Джовани Рубайс работи в Института по история и етика на медицината към Университета на Хайделберг и се занимава основно с етичните аспекти на дигиталната трансформация. Рубайс задава въпроса как следва да изглежда една правна рамка, която е в унисон с времето? В крайна сметка секторът на медицинските технологии генерира една трета от оборота си от изделия, които са по-стари от три години.
„Системата на здравеопазването се променя бързо: например към момента могат да бъдат изтеглени над 10 000 приложения за психотерапия. Те всъщност медицински изделия ли са? И как тези нови приложения с изкуствен интелект, които изглеждаха немислими преди няколко години, се класифицират и регулират? Икономиката превръща знанията в изделия толкова бързо, че законодателят едва смогва на темпото. Технологичната трансформация ще подложи на изпитание и MDR. Интересът на пациента е съвсем ясен: изделието трябва да ми помага. И да е безопасно. От етична гледна точка следва да приветстваме затягането и прецизирането на регулаторната рамка. Повод за размисъл според мен е, че допълнителните разходи следва да бъдат посрещани от сходни нива на ресурси и осигуреност с персонал. Това не е достатъчно за приемането на един закон. Следва да бъдат осигурени също подходящата инфраструктура и ресурси. MDR е много сложно начинание. А също и етичен проблем. Защото не е лесно за пациентите, а дори и за медицинските специалисти, да се ориентират. Вярно е, че цялата информация следва да е достъпна в базата данни EUDAMED. Тя обаче няма да е готова преди 2024 г. и е основно предназначена за специалисти. Разбира се, повечето хора имат доверие на своя лекар. Един регламент обаче не е достатъчен за повишаване на загубеното доверие в сектора на медицинските изделия. Политиците и бизнесът трябва да помислят как да общуват с пациентите и да им предоставят цялата необходима информация, за да могат сами да вземат решение.“